Zatímco u čistých kapalin se téměř okamžitě ustaví rovnovážná hodnota
povrchového napětí, u roztoků se povrchové napětí čerstvě utvořených povrchů liší od povrchového napětí rovnovážných systémů, protože složení nově vzniklého a rovnovážného povrchu jsou různá vzhledem k tomu, že dochází k
adsorpci na fázovém rozhraní. Povrchové napětí roztoků se mění s jejich koncentrací.
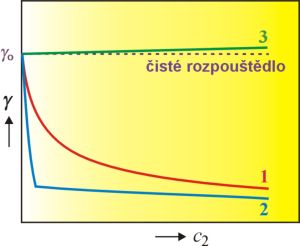
Jak ukazuje obr. 1, vliv rozpuštěné látky na povrchové napětí může být různý podle povahy jak rozpuštěné látky, tak rozpouštědla. Některé látky již v malých koncentracích vyvolávají znatelné snížení povrchového napětí (křivky
1 a
2). Takové látky jsou označovány jako
povrchově aktivní. Křivka
1 je typická pro vodné roztoky většiny povrchově aktivních ve vodě rozpustných organických sloučenin. Křivka
2 ukazuje chování vysoce povrchově aktivních látek s
amfifilní stavbou molekul, které nejprve výrazně snižují povrchové napětí a při
kritické micelární koncentraci se pokles s počínající tvorbou
micel zastaví. U některých systémů, např. u vodných roztoků anorganických elektrolytů nebo vysoce hydratovaných organických sloučenin, je pozorováno naopak zvýšení povrchového napětí (křivka
3). Tento efekt není velký a je pozorovatelný až při vyšších koncentracích. Tyto látky jsou označovány jako
povrchově inaktivní. Jsou také možné případy, kdy rozpuštěná látka nevyvolá měřitelnou změnu
γo (např. roztok cukru ve vodě).
Pro analytické vyjádření závislosti povrchového napětí na složení byla navržena řada semiempirických vztahů, které slouží k interpolaci i extrapolaci dat. V malém koncentračním rozmezí lze koncentrační závislost vystihnout polynomem vhodného stupně, jehož konstanty zjistíme z experimentálních dat lineární regresí. Jedna z nejznámějších rovnic, která dobře vystihuje průběh koncentrační závislosti povrchového napětí
vodných roztoků řady organických látek, je empirická
rovnice Szyszkowského.