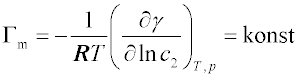kde
a2 je aktivita složky 2,
c2 její koncentrace v objemové fázi,
Γ2,1 je
relativní adsorpce, tj. rozdíl látkových množství složky 2 v povrchové vrstvě a v roztoku, jestliže oba údaje jsou vztaženy na stejné látkové množství složky 1 a na jednotkovou plochu povrchu.
Γ2,1 není přímo měřitelná, ale je možno ji vypočítat z koncentrační závislosti povrchového nebo mezifázového napětí
γ, které lze dobře měřit (viz
povrchové napětí,
mezifázové napětí kapalina-kapalina). Složka 2 je pozitivně adsorbována, jestliže snižuje povrchové napětí rozpouštědla -
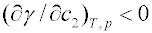
; jestliže zvyšuje povrchové napětí -
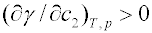
- je adsorbována negativně, tzn. její koncentrace v povrchové vrstvě je nižší než v objemové fázi.
U vodných roztoků povrchově aktivních látek, jejichž koncentrační závislost povrchového napětí lze vyjádřit
Szyszkowského rovnicí, dosáhne při zvyšování koncentrace adsorbující se složky v objemové fázi hodnota relativní adsorpce maximální hodnoty
Γm, která již nestoupá. Gibbsova adsorpční izoterma má pak tvar
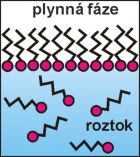
To odpovídá představě, že se na povrchu utvoří nasycená
monovrstva, v níž jsou molekuly těsně uspořádány: hydratované polární skupiny jsou zakotveny ve vodné fázi a uhlíkové řetězce jsou rovnoběžné a směřují z vodné fáze (obr. 1).
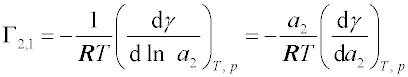
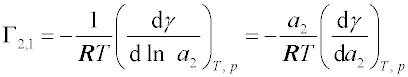
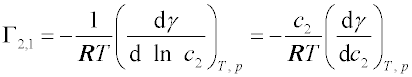
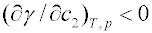 ; jestliže zvyšuje povrchové napětí -
; jestliže zvyšuje povrchové napětí - 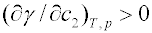 - je adsorbována negativně, tzn. její koncentrace v povrchové vrstvě je nižší než v objemové fázi.
- je adsorbována negativně, tzn. její koncentrace v povrchové vrstvě je nižší než v objemové fázi.