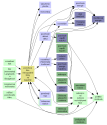
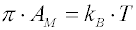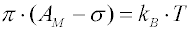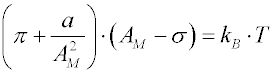povrchový film nerozpustné látky na kapalině
surface film on liquid substrate
Vrstva vytvořená na hladině kapaliny
rozestíráním látky v této kapalině velmi málo rozpustné. Kapalina, na jejímž povrchu dochází k rozestírání (substrát), bývá voda, která má velkou
povrchovou energii. Molekuly rozestíraných látek se skládají z nepolárního uhlovodíkového řetězce a polární skupiny. Dostatečně dlouhý uhlovodíkový řetězec je příčinou jejich malé rozpustnosti ve vodě, polární skupina způsobuje rozprostírání na vodní hladině. Povrchové filmy mohou být tvořeny nejen ve vodě nerozpustnými kapalinami, ale i tuhými látkami. Ty je třeba nejdříve rozpustit ve vhodném těkavém rozpouštědle s kladným
rozestíracím koeficientem, které se po rozprostření vypaří.
Povaha rozestřené vrstvy závisí na množství rozprostírané kapaliny, na ploše povrchu i na teplotě. Studovány byly zvláště monomolekulární povrchové filmy, tzv.
monovrstvy, (
Langmuirovy vrstvy), které přinesly mnoho nových poznatků o struktuře a vlastnostech
povrchově aktivních látek. Při větším množství rozestírané látky umístěné na povrch se vytvářejí vícevrstvé filmy a je-li použit velký přebytek, může vzniknout monovrstva a zbytek materiálu vytvoří na povrchu kapky; mezi kapkami a monovrstvou se ustaví rovnováha.
Vlastnosti povrchových filmů
Důsledkem přítomnosti filmu na povrchu vodné fáze je snížení povrchového napětí. Povrchový film je popisován dvourozměrnými stavovými proměnnými:
povrchovým tlakem π (rozdíl mezi povrchovým napětím čistého povrchu a povrchu pokrytého filmem), pokrytou plochou
A, látkovým množstvím materiálu v povrchové vrstvě
n a teplotou
T. Závislost mezi stavovými proměnnými se vyjadřuje
π–AM izotermami (
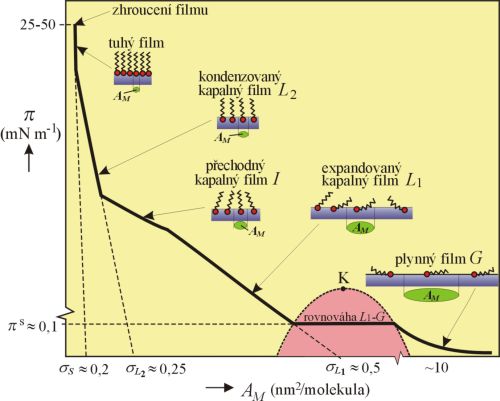
AM je plocha připadající ve filmu na jednu molekulu). Monovrstvy vytvářené na vodných površích se mohou vyskytovat v různých agregátních stavech. Příklady různých možností ukazuje fázový diagram
π–AM (není nakreslen v měřítku):
 |
|
|
Obr. 1 Schematický fázový diagram pro různé typy povrchových filmů
|
Při malém množství látky rozestřené na velké ploše vzniká tzv. plynný povrchový film. Molekuly, tvořící film jsou od sebe vzdáleny, obklopeny molekulami vody, takže se vzájemně velmi málo ovlivňují. Závislost povrchového tlaku π–AM může být při velmi nízkých tlacích popsána dvoudimenzionálním ekvivalentem stavové rovnice ideálního plynu
kde
kB je Boltzmannova konstanta. Při vyšších hodnotách
π se projevují odchylky od ideálního chování stejně jako u plynné fáze. Chování reálného povrchového filmu může být pak popsáno např.
Volmerovou rovnicí
nebo dvourozměrnou analogií van der Waalsovy rovnice
kde
σ je korekce na plochu průřezu reálné molekuly (tzv.
vyloučená plocha), pro níž se používá té z extrapolovaných hodnot
σS,
σL2, nebo
σL1 (viz obr. 1), s níž uvedené rovnice nejlépe vyhovují experimentálním datům. Konstanta
a charakterizuje přitažlivé síly mezi adsorbovanými molekulami.
Při stlačování filmu (zmenšování plochy filmu při konstantním množství rozestřené látky) nastává při určité konstantní hodnotě π = πs (vodorovná část křivky mezi kapalným a plynným filmem) kondenzace filmu podobně jako u rovnováhy kapalina-pára. πs je dvourozměrná analogie tlaku nasycené páry kapaliny (odpovídá rovnováze mezi plynným a kapalným monomolekulárním filmem); tento tlak je velmi nízký (řádově 0,1 mN m–1) a jeho teplotní závislost může být popsána se vztahem podobným Clausiově-Clapeyronově rovnici. Z naměřených teplotních závislostí tohoto tlaku byla vypočítána výparná tepla dvourozměrných kapalin; jejich hodnoty se blíží spíše výparným teplům uhlovodíků než polárních kapalin. Přechod mezi kapalným a plynným filmem se tedy zřejmě týká hlavně uhlovodíkových řetězců, zatímco polární skupiny zůstávají stále zakotveny ve vodné fázi. S rostoucí teplotou se vodorovná část křivky zkracuje a nad tzv. dvourozměrnou kritickou teplotou (bod K) vymizí. Heterogenní oblast je v diagramu vymezena čárkovanou čarou.
Kondenzací plynného filmu vzniká tzv. expandovaný kapalný film L1, v němž je plocha připadající na jednu molekulu značně větší než plocha průřezu molekuly, cca 0,3 – 0,5 nm2. Tloušťka filmu je menší než délka řetězce molekul povrchově aktivní látky. Molekuly se volně pohybují podél povrchu. S růstem povrchového tlaku se tloušťka filmu zvětšuje a na křivce π–AM se objevuje přechodová oblast I, která dosud nebyla uspokojivě vysvětlena. Při dalším stlačování tvoří monovrstva kondenzovaný kapalný film L2, jehož stlačitelnost je v důsledku silnějších mezimolekulárních interakcí menší než u filmů L1. Extrapolace na nulový tlak poskytuje hodnoty σL1 ≈ 0,25 nm2, které jsou jen o málo větší než průřez molekuly. Některé látky, např. vyšší mastné kyseliny tvoří při vyšších teplotách tyto filmy, aniž jim předchází vznik expandovaných filmů.
Další stlačování vede ke vzniku tzv. tuhých filmů (jsou označovány také jako tekuté krystaly) s ještě menší stlačitelností než u kondenzovaných kapalných filmů. Nejdůležitější rozdíly mezi kapalným kondenzovaným a pevným filmem se projevují v reologických vlastnostech; v kapalných filmech nastává tok již při malých střihových napětích, pevné filmy jsou schopné snášet značná střihová napětí bez trvalé deformace. Extrapolace strmé části křivky na nulovou hodnotu povrchového tlaku vede pro řadu organických látek, u nichž je uhlovodíkový řetězec zakončen jednou polární skupinou (např. –COOH nebo –OH) ke zhruba stejné hodnotě, 0,205 nm2, nezávislé na délce uhlovodíkového řetězce. Tato extrapolovaná hodnota představuje velikost plochy připadající v tomto filmu na jednu molekulu. To odpovídá představě, že za těchto podmínek jsou molekuly těsně uspořádány v monomolekulární vrstvě; dlouhé osy všech molekul jsou orientovány kolmo k povrchu a polární skupiny jsou vázány na vodnou fázi. Plocha, kterou molekula zaujímá na povrchu vodné fáze, je dána jejím průřezem, kolmým na osu uhlíkového řetězce. Pro různé skupiny organických látek je ovlivněna jejich strukturou. Tato plocha je větší než 0,205 nm2, jestliže v molekule je přítomno více polárních skupin, jestliže z jedné polární skupiny vychází více uhlovodíkových řetězců, jsou-li uhlovodíkové řetězce rozvětvené nebo zkroucené, popř. má-li koncová polární skupina velké rozměry. Tloušťka monomolekulární vrstvy se zvětšuje s délkou uhlovodíkového řetězce, přibližně o 1,4∙10–10 m na každou další CH2– skupinu.
Při velkém zvýšení tlaku (obr. 1) dochází ke zhroucení uspořádané struktury filmu. Tento děj je nerovnovážný a potřebný tlak je velmi citlivý na rychlost, kterou je film stlačován.
 |
|
|
Obr. 2 Schéma zhroucení filmu
|
Více o povrchových filmech:
[
2, str. 106], [
32, str. 300], [
85, str. 197], [
88, str. 102], [
77, str. 90]
Grafy souvislostí do úrovně:
I  II
II