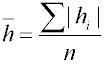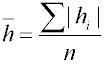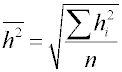povrch tuhé látky
surface of solid
Fázové rozhraní mezi plynnou a tuhou fází. Pevné povrchy jsou velmi rozdílné vzhledem k velmi rozdílné struktuře a povaze samotných pevných látek. I u nejjednodušší možné formy pevné látky - monokrystalu - existují krystalové roviny, hrany a rohy, které se od sebe liší povrchovou energií. U běžných pevných látek nejde o monokrystaly, ale např. o agregáty malých krystalů ve všech možných orientacích s amorfním materiálem v mezerách. V obou případech existuje spousta možností vzniku složitých struktur, dutin a výstupků.
Pevné povrchy bývají často studovány při pokojových teplotách, tedy obvykle hluboko pod bodem tání. Povrchové atomy jsou za těchto podmínek relativně nepohyblivé, pouze vibrují kolem svých rovnovážných poloh. Na rozdíl od kapalin proto bývá povrch pevných látek nerovný v mikroměřítku i v makroměřítku.
K posouzení nerovnosti povrchů se používá řada charakteristik, jako např. profilové křivky (průsečnice povrchu s rovinou kolmou k povrchu), rozdíl nejvyššího a nejnižšího bodu povrchu, střední odchylka
nebo střední kvadratické odchylka
kde hi je odchylka výšky povrchu v i-tém bodě od průměrného povrchu (tj. rovný povrch hypotetického tělesa se stejným objemem, pro který Σh = 0), n je počet měření. Pro charakteristiku pórovité látky se často používá poměru plochy skutečného povrchu vzorku k ploše povrchu geometrického. Ke zjišťování nerovnosti povrchu se používá různých fyzikálních, většinou optických metod.
Grafy souvislostí do úrovně:
I  II
II