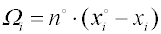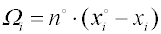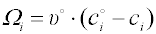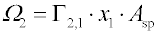adsorpce z kapalné fáze na tuhé látce
adsorption at solid/liquid interface
Při styku tuhých látek s kapalinami je k povrchu tuhé látky vázána vrstva molekul kapaliny – dochází k
adsorpci, a to i v případě, že se jedná o čistou kapalinu. Adsorbovaná vrstva –
lyosféra - se při vzájemném pohybu tuhé látky a kapaliny nepohybuje s kapalinou, ale lpí na pevném povrchu. Molekuly kapaliny v této vrstvě jsou vlivem silového pole tuhé látky stlačené, případně i různě orientované, ale změna hustoty je vzhledem k malé stlačitelnosti kapalin nepatrná. Adsorpce čistých kapalin na tuhých látkách je proto neměřitelná; na její rozsah je možné pouze soudit, např. z hodnot
smáčecích tepel nebo
úhlů smáčení.
Při styku pevného
adsorbentu s kapalnými
roztoky se neadsorbují všechny složky ve stejné míře a v důsledku toho dochází ke změně ve složení roztoku, kterou je možno stanovit různými analytickými metodami. Stejně jako u
adsorpce z plynné fáze mohou mezi adsorbentem a složkami roztoku působit síly fyzikální (
fyzikální adsorpce), nebo mohou vznikat chemické vazby – dochází k
chemisorpci.
Podle druhu adsorbujících se částic se obvykle rozlišuje
molekulární adsorpce, kdy se adsorbují celé molekuly nebo oba druhy iontů elektrolytu ve stejné míře, a
iontová adsorpce, při níž se přednostně adsorbuje jeden druh iontů.
Experimentální stanovení je poměrně jednoduché: známé množství roztoku o známém složení je ponecháno po dostatečně dlouhou dobu ve styku se známým množstvím tuhého adsorbentu a pro ustavení rovnováhy je roztok oddělen a zjištěno jeho nové složení.
Kvantitativní charakteristikou adsorpce z roztoku na povrchu tuhé látky je veličina nazývaná
zdánlivá nebo také
preferenční adsorpce
Ωi (někdy je používáno také symbolu
ai), vyjadřovaná pomocí změny koncentrace roztoku
nebo
kde xio a xi , popř. cio a ci jsou molární zlomky, popř. koncentrace složky i v roztoku před adsorpcí (horní index) a v rovnovážném roztoku po adsorpci, no je látkové množství a υo objem roztoku před adsorpcí, vztažený na jednotku hmotnosti adsorbentu. Je-li Ωi > 0, říkáme, že složka i je preferenčně adsorbována.
Preferenční adsorpce je funkcí teploty a rovnovážné koncentrace roztoku. Obvykle se stanovuje závislost
Ωi na rovnovážné koncentraci za konstantní teploty -
izoterma koncentrační změny (též
složená nebo
kompozitní izoterma).
Preferenční adsorpce má obdobný význam jako
relativní adsorpce. Přebytek adsorbované látky v povrchové fázi vůči fázi objemové je zde vztažen ne na jednotku plochy, ale na jednotku hmotnosti adsorbentu. Mezi veličinami
Ω2 a
Γ2,1 (viz
Gibbsovu adsorpční izotermu), platí vztah
K úplnému popisu adsorpční rovnováhy by bylo třeba znát kromě složení rovnovážného roztoku ještě celkové látkové množství všech složek
ns , naadsorbované na jednotce hmotnosti tuhého adsorbentu a složení adsorbované fáze, tj.
individuální izotermy.
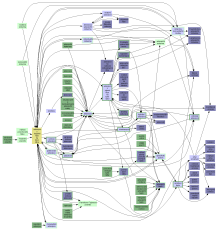
Grafy souvislostí do úrovně:
I  II
II