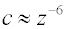stabilizace elektrickou dvojvrstvou
electrostatic stabilization
Připadá v úvahu především u
hydrosolů. Jádro
micely bývá krystalické povahy, tvořené krystalkem ultramikroskopických rozměrů nebo agregátem, vzniklým koagulací primárních krystalků. Povrch jádra může získat elektrický náboj (např. ionizací povrchu, přednostním rozpouštěním některého z iontů mřížky nebo naopak preferenční adsorpcí iontů, které tvoří s některým z iontů mřížky nerozpustnou sloučeninu). K nabitému povrchu jsou pak přitahovány protiionty a vytvoří se
elektrická dvojvrstva.
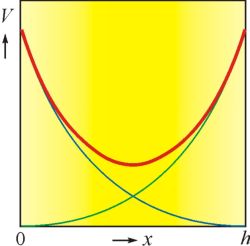
Při přibližování dvou stejně nabitých disperzních částic se difuzní části jejich elektrických dvojvrstev navzájem prostupují. V mezeře mezi povrchy částic šířky h se při přibližování částic mění prostorové rozložení iontů, a tím i profily potenciálu a místní hustoty náboje. Elektrický potenciál v daném bodě je určen součtem potenciálů jednotlivých dvojvrstev (obr. 1). Při zužování mezery dochází k desorpci iontů, vzrůstá Gibbsova energie systému a to vede ke vzniku odpudivé síly mezi částicemi, které se vlivem tepelného pohybu od sebe opět vzdálí.
 |
|
|
Obr. 1 Změna elektrického potenciálu v prostoru mezi povrchy dvou částic s elektrickými dvojvrstvami. Celkový potenciál (červená křivka) je součtem potenciálů u samostatných povrchů (zelená a modrá křivka)
|
Podle
teorie DLVO závisí tato odpudivá síla na druhé mocnině potenciálu Sternovy vrstvy a na poměru tloušťky mezery k
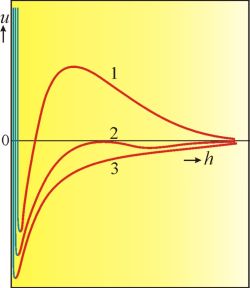
efektivní tloušťce dvojvrstvy. Čím je tento poměr menší, tím více se elektrické dvojvrstvy překrývají a tím silnější je repulzní účinek. Výsledná interakční energie je pak dána součtem odpudivých elektrostatických sil s přitažlivými silami Londonovými. Průběh závislosti interakční energie na vzdálenosti částic při různých iontových silách (koncentracích elektrolytu v disperzním prostředí) pro dvě kulovité koloidní částice ukazuje obr. 2. Všechny křivky mají hluboké minimum pro velmi malá
h, kdy přitažlivé působení mezi částicemi je maximální - stabilním stavem jsou agregované částice. Při středních hodnotách
h se na křivkách objevují maxima, jejichž výška závisí na koncentraci elektrolytu v disperzním prostředí (tj. na tloušťce elektrické dvojvrstvy). Maxima představují energetické bariéry, které dvě částice musí překonat, aby se dostaly do nejstabilnější konfigurace. Je-li bariéra velmi vysoká (křivka 1),
agregace prakticky neprobíhá - disperzní systém je stabilizován; z termodynamického hlediska je však v metastabilním stavu, protože není v nejhlubším možném energetickém minimu. Křivka 3 znázorňuje stav systému při vysokých iontových silách (částice nejsou chráněny elektrickou dvojvrstvou), systém ztrácí stabilitu a částice agregují.
 |
|
Obr. 2 Průběh závislosti interakční energie na vzdálenosti částic při různých koncentracích elektrolytu v disperzním prostředí.
Koncentrace elektrolytu stoupá s číslem křivky.
Modré části křivek představují oblast působení odpudivých sil, které se uplatňují při malých vzdálenostech v reálných systémech, teorie DLVO neuvažuje.
|
Křivka 2, která se dotýká osy úseček, ale nepřekračuje nulovou hodnotu interakční energie odpovídá koncentraci elektrolytu, která je právě rovna
koagulačnímu prahu. Z teorie DLVO byl pro hodnotu koagulačního prahu (
c) v závislosti na náboji
protiiontu (
z) přidávaného elektrolytu odvozen vztah
který souhlasí s experimentálně zjištěným
Schulzovým-Hardyho pravidlem a může být považován za potvrzení platnosti teorie DLVO. Neplatí však obecně, v řadě případů je třeba uvažovat ještě vliv dalších faktorů, jako jsou např. specifická adsorpce iontů a jejich hydratace.
Stabilita lyosolu bývá často charakterizována hodnotou
elektrokinetického potenciálu, neboť jeho pokles má stejný důvod jako pokles odpudivých sil -
stlačování elektrické dvojvrstvy. Stabilita lyosolů zajišťovaná elektrickou dvojvrstvou může být tedy snadno narušena i malými změnami ve složení disperzního prostředí.
Grafy souvislostí do úrovně:
I  II
II