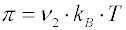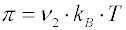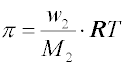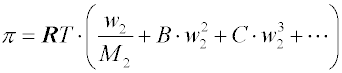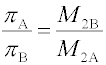koloidní osmotický tlak
colloid osmotic pressure
Osmotický tlak koloidního systému (
koloidní částice +
disperzní prostředí), odděleného od disperzního prostředí
membránou, která propouští všechny složky systému kromě koloidních (tj. všechny malé molekuly). Osmotický tlak je jediná z koligativních vlastností, která je měřitelná i v koloidních systémech, i když jeho hodnota je o dva až tři řády menší než u analytických disperzí.
Pro osmotický tlak
zředěných ideálních koloidních soustav platí
van’t Hoffova rovnice, v níž je koncentrace většinou vyjadřována jako počet disperzních částic v jednotce objemu,
ν2 = N2/V:
(kB je Boltzmannova konstanta), nebo hmotnost disperzního podílu m2 v jednotce objemu V (hmotnostní koncentrace w2 = m2/V; v polymerní literatuře je pro hmotnostní koncentraci používán symbol c2)
Pro neideální roztoky byly navrženy viriální rozvoje tvaru
kde B, C... jsou viriální koeficienty, které se určují z experimentálních dat. Nejčastěji se používají jen první dva členy rozvoje (tzv. dvoukonstantové rovnice).
Jak je patrné, klesá osmotický tlak s rostoucí velikostí částic. Pro dva koloidní systémy A a B o stejné hmotnostní koncentraci disperzních částic, které se liší velikostí, platí
Osmotický tlak klesá, jestliže se částice slepují nebo tvoří agregáty, naopak vzrůstá při rozpadu agregátů.
Měření osmotického tlaku se využívá ke stanovení molární hmotnosti vysokomolekulárních látek, které tvoří pravé roztoky, jejichž stabilizace nevyžaduje přítomnost elektrolytů a mohou být připraveny v dostatečně vysoké koncentraci. U roztoků polyelektrolytů je však hodnota osmotického tlaku značně ovlivněna stupněm jejich elektrolytické disociace a nízkomolekulárními elektrolyty, v jejichž přítomnosti se ustavují
Donnanovy rovnováhy.
Grafy souvislostí do úrovně:
I  II
II