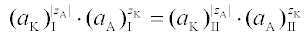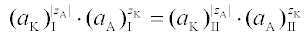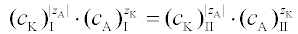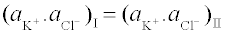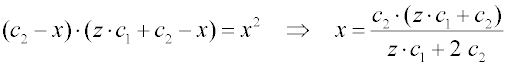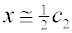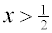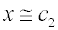Donnanova rovnováha
Donnan equilibria
Podmínka rovnováhy, odvozená z rovnosti elektrochemických potenciálů pro ionty schopné procházet membránou, je vyjádřena vztahem mezi aktivitami procházejících iontů v obou odděleních po ustavení rovnováhy:
Ve zředěných roztocích je možno nahradit aktivity koncentracemi:
kde aK, aA jsou aktivity kationtu a aniontu v prostoru I nebo II, cK, cA jsou jejich koncentrace, zK, popř. zA počet elementárních nábojů nesených kationtem, příp. aniontem. Podmínkou Donnanovy rovnováhy nejsou tedy stejné aktivity (koncentrace) jednotlivých iontů na obou stranách membrány, ale součin aktivit (koncentrací) obou iontů nízkomolekulárního elektrolytu.
Důsledkem přítomnosti velkých iontů je nerovnoměrné rozdělení nízkomolekulárních iontů mezi roztoky po obou stranách membrány.
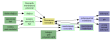
Např.: V nádobě, rozdělené polopropustnou membránou na dvě oddělení stejného objemu, je v jednom (I) na počátku umístěn roztok, který obsahuje vysokomolekulární elektrolyt Pz+(Cl-)z o koncentraci c1, a současně nízkomolekulární elektrolyt, např. KCl v koncentraci c2, a v druhém (II) je čistá voda. Aby se mezi odděleními ustavila rovnováha, musí membránou prodifundovat z prostoru I do prostoru II x molů chloridových iontů a aby byla na obou stranách membrány zachována elektroneutralita, také x molů iontů draselných. Za předpokladu úplné disociace obou elektrolytů platí pro koncentrace jednotlivých iontů následující bilance
|
na počátku
|
v rovnováze
|
|
I
|
II (čistá voda)
|
I
|
II
|
|
Pz+
|
c1
|
0
|
c1
|
0
|
|
Cl–
|
z∙c1 + c2
|
0
|
z∙c1 + c2 - x
|
x
|
|
K+
|
c2
|
0
|
c2 - x
|
x
|
Podmínka rovnováhy platí pro procházející ionty:
Z tohoto vztahu plyne, že
-
při velmi malé koncentraci koloidní složky, c1 << c2, se nízkomolekulární elektrolyt rozdělí téměř rovnoměrně mezi obě oddělení (to platí tím lépe, čím menší je náboj vysokomolekulárního iontu):
-
jsou-li obě koncentrace souměřitelné, c1 ≈ c2, projde membránou do čisté vody vždy více než 50 % nízkomolekulární složky,
-
je-li koloidní složka ve velkém nadbytku, c1 >> c2, prodifunduje do čisté vody téměř všechen nízkomolekulární elektrolyt:
Grafy souvislostí do úrovně:
I  II
II