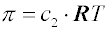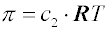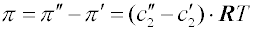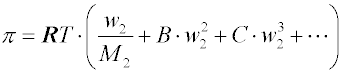osmotický tlak
osmotic pressure
Přetlak, kterým je nutno působit na straně roztoku, odděleného od čistého rozpouštědla
membránou, propustnou pouze pro molekuly rozpouštědla, aby byl zastaven průtok rozpouštědla membránou do roztoku (viz
osmóza). Pro zředěné ideální roztoky platí
van’t Hoffova rovnice
kde
c2 je koncentrace (látkové množství v jednotce objemu), příp. součet koncentrací všech složek roztoku, které neprocházejí membránou. Van't Hoffova rovnice platí exaktně pro
nekonečně zředěné (
ideální) roztoky.
Osmometrická měření se provádějí při různých koncentracích a výsledky se extrapolují na nulovou koncentraci.
Jsou-li membránou odděleny dva různě koncentrované roztoky, je tlak, kterým je možno zastavit osmózu, roven rozdílu jejich osmotických tlaků:
Při výpočtu osmotického tlaku roztoků elektrolytů je třeba nahradit koncentraci c2 ve van’t Hoffově rovnici celkovou koncentrací částic, vznikajících disociací.
Pro neideální roztoky byly navrženy viriální rozvoje tvaru
kde w2 je hmotnostní koncentrace. Nejčastěji se používají jen první dva členy rozvoje (tzv. dvoukonstantové rovnice). Konstanty viriálních rozvojů se určují z experimentálních dat.
Osmotický tlak je jediná z koligativních vlastností, která je měřitelná nejen u analytických, ale i u koloidních roztoků (viz
koloidní osmotický tlak). Pro analytické roztoky dosahuje osmotický tlak velikosti řádově
200 kPa, pro koloidní soustavy je o dva až tři řády menší.
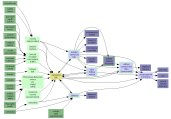
Grafy souvislostí do úrovně:
I  II
II