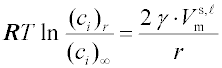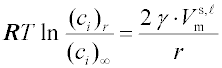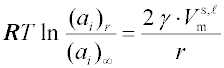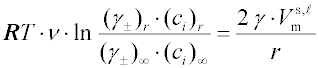Ostwaldova-Freundlichova rovnice
Ostwald-Freundlich equation
(odvozena W. Ostwaldem 1900, korigována Freundlichem) Závislost rozpustnosti málo rozpustných tuhých nebo kapalných látek na velikosti jejich částic:
kde
(ci)r je rozpustnost malých krystalů (kapek) o ekvivalentním poloměru
r a
(ci)∞ rozpustnost velkých částic (
r → ∞) a
γ mezifázové napětí tuhá (kapalná) látka – nasycený roztok; pro binární systémy má stejný tvar jako
Kelvinova rovnice.
Z podmínky rovnováhy - rovnost chemických potenciálů v obou fázích pro každou ze složek - lze pro binární systémy obdobným postupem jaký byl použit při odvození Kelvinovy rovnice, odvodit vztah popisující rovnováhu pomocí aktivit.
Při malé rozpustnosti je možno předpokládat, že poměr aktivit je roven poměru koncentrací a vztah přechází na výše uvedenou Ostwaldovu-Freundlichovu rovnici.
Rozpustnost tuhé (kapalné) látky stoupá s klesajícím rozměrem částice, což opět vede k nestabilitě disperzních systémů (velké krystalky rostou na úkor malých – pochod známý jako
Ostwaldovo zrání) a rovněž vysvětluje známou skutečnost, že ke krystalizaci ze zcela čistých roztoků může dojít pouze při velkém přesycení.
Jestliže se jedná o elektrolyty, je třeba uvažovat disociaci elektrolytu:
ν (= ν+ + ν–) je počet iontů, vznikajících disociací, γ± střední aktivitní koeficienty; nelze-li předpokládat, že poměr středních aktivitních koeficientů pro fázi se zakřiveným a rovinným rozhraním se blíží jedné, je možno pro výpočet γ± použít Debyeova-Hückelova zákona.
Ostwaldova-Freundlichova rovnice umožňuje vypočítat mezifázové napětí tuhá (kapalná) látka – nasycený roztok z rozpustnosti částic o známé velikosti.
Grafy souvislostí do úrovně:
I  II
II