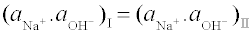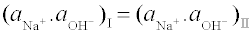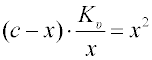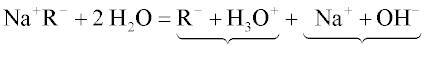membránová hydrolýza
membrane hydrolysis
Zvláštní případ
Donnanovy rovnováhy, kdy je roztok obsahující pouze
polyelektrolyt bez dalších nízkomolekulárních iontů oddělen od čisté vody
polopropustnou membránou, kterou může procházet pouze nízkomolekulární ion. Aby byla zachována podmínka elektroneutrality, difundují spolu s ním ionty opačného znaménka, které vznikají buď hydrolýzou vysokomolekulárních iontů nebo disociací vody. Membrána, která odděluje
disperzní systém od čisté vody, tedy způsobí pokles
pH v jednom oddělení a vzestup
pH v oddělení druhém. Celkový efekt pochodu je hydrolýza vysokomolekulárního elektrolytu.
Např. Roztok polyelektrolytu Na+R– o koncentraci c (prostor I) je oddělený polopropustnou membránou od stejného objemu čisté vody (prostor II). Aby se ustavila rovnováha, je třeba, aby určité množství sodných iontů (x) přešlo z prostoru I do prostoru II. S nimi přechází stejné množství hydroxylových iontů, vznikajících disociací vody. V oddělení, které původně obsahovalo čistou vodu (II), se tedy hromadí NaOH, v druhém oddělení (I) hydroxoniové ionty:
|
na počátku
|
rovnováha
|
| I |
II |
I |
II |
|
R-
|
c
|
|
c
|
|
|
Na+
|
c
|
|
c-x
|
x
|
|
OH-
|
|
|
|
x
|
|
H3O+
|
|
|
x
|
|
Podmínku rovnováhy je třeba psát pro elektrolyt, který prochází membránou (zde pro NaOH).
Aktivita hydroxylových iontů v prostoru I v rovnováze je dána iontovým součinem vody. Ve zředěných roztocích, kde je možno nahradit aktivity koncentracemi, platí
Celý děj může být vystižen schematickou rovnicí
Grafy souvislostí do úrovně:
I  II
II