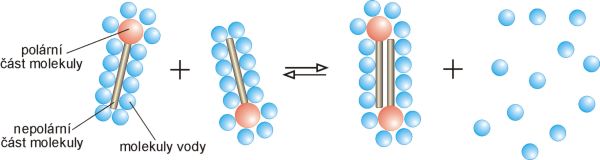
Zvýšená přitažlivost mezi dvěma částicemi ve vodném prostředí, v němž jsou interakce částice-voda slabší než interakce mezi molekulami vody.
Nepolární skupiny mají ve vodných roztocích tendenci se spojovat a tím zmenšit kontakt se sousedními molekulami vody (obr. 1). Jev je spojen se zvláštností struktury vody jako rozpouštědla. Při běžných teplotách vedou
vodíkové vazby mezi molekulami vody k vysoké uspořádanosti molekul, která do jisté míry připomíná uspořádanost v krystalech ledu. Přidání molekul
povrchově aktivních látek, které obsahují uhlovodíkové řetězce, vede ke zvýšení uspořádanosti molekul vody v okolí uhlovodíkového řetězce a tedy k poklesu entropie. Sdružením molekul
PAL do
micely se tato uspořádanost zmenší – entropie roste. Mimo to se zabudováním do micely zvětší pohyblivost uhlovodíkového řetězce a tím se zvýší i entropie (molekuly vody obklopující řetězec omezují rotaci kolem
C–C vazeb).