kinetika adsorpce
kinetics of adsorption
Vlastní adsorpce na snadno dostupném povrchu je v případě
fyzikální adsorpce velmi rychlá, prakticky okamžitá.
V případě
chemisorpce jde o chemickou reakci a její rychlost je vyjádřena kinetickými vztahy, obdobnými vztahům pro vratné reakce: např. pro jednoduchou adsorpci (tj. bez disociace adsorbující se látky), je rychlost chemisorpce dána rozdílem rychlostí vlastní
adsorpce a
desorpce
kde
aB je aktivita adsorbující se látky B u povrchu,
cB povrchová koncentrace již adsorbované látky B,
cn koncentrace neobsazených
aktivních center,
KB je rovnovážná konstanta adsorpce
a kB je rychlostní konstanta adsorpce, která je funkcí teploty,
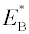
je aktivační energie adsorpce látky B a
A frekvenční faktor. Rychlost chemisorpce je tedy, stejně jako rychlost chemické reakce, exponenciálně závislá na reciproké teplotě a stoupá se vzrůstající teplotou. Při nízkých teplotách je velmi malá a chemisorpce je někdy dokonce neměřitelná.
Při adsorpci na porézních adsorbentech je ovšem třeba uvažovat sled dějů, které mají vliv na výslednou rychlost celého pochodu:
-
difuze k vnějšímu povrchu adsorbentu (vnější difuze)
-
difuze póry k vlastnímu povrchu adsorbentu (vnitřní difuze)
-
vlastní adsorpce
Nejpomalejším, tedy řídícím dějem zde může být jak difuze tak vlastní adsorpce. V případě fyzikální adsorpce na porézních adsorbentech bývá řídícím dějem difuze póry adsorbentu, u chemisorpce je nejčastěji nejpomalejším dějem aktivovaná adsorpce.
Grafy souvislostí do úrovně:
I  II
II 
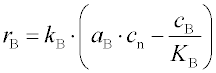
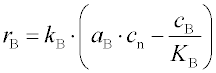
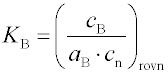
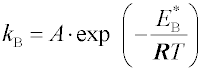
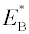 je aktivační energie adsorpce látky B a A frekvenční faktor. Rychlost chemisorpce je tedy, stejně jako rychlost chemické reakce, exponenciálně závislá na reciproké teplotě a stoupá se vzrůstající teplotou. Při nízkých teplotách je velmi malá a chemisorpce je někdy dokonce neměřitelná.
je aktivační energie adsorpce látky B a A frekvenční faktor. Rychlost chemisorpce je tedy, stejně jako rychlost chemické reakce, exponenciálně závislá na reciproké teplotě a stoupá se vzrůstající teplotou. Při nízkých teplotách je velmi malá a chemisorpce je někdy dokonce neměřitelná.